Group for Personalized Treatment of Postmastectomy Syndrome
Group for Personalized Treatment of Postmastectomy Syndrome



Руководитель группы: ведущий научный сотрудник Поспелова Мария Львовна
Основные задачи
- Выявление структурных, функциональных и метаболических маркеров повреждения головного мозга и разработка МР-семиотики изменений рабочих сетей головного мозга у пациенток с постмастэктомическим синдромом.
- Сопоставление результатов активности рабочих сетей головного мозга у пациенток с постмастэктомическим синдромом с клинической картиной, результатами нейропсихологического исследования, данными метаболизма головного мозга и лимфосцинтиграфии и электронейромиографии верхних конечностей для отработки нейросетевого алгоритма для послеоперационной превенции осложнений, определения персонифицированной тактики и эффективности лечебно-реабилитационных мероприятий.
- Выявление генетических маркеров нарушений лимфатического русла (локальных и распространенных), как проявлений иммунозависимой патологии – нарушений пролиферации (доброкачественных и злокачественных) и врожденных пороков развития для проведения предикции их развития в послеоперационном периоде.
- Клиническое внедрение и отработка новых алгоритмов предикции и персонифицированного подхода к лечебно-реабилитационным мероприятиям у пациенток с постмастэктомическим синдромом.
Направления работы
Название проекта: «Разработка персонифицированных программ предикции и реабилитации пациенток с постмастэктомическим синдромом (ПМЭС) на основе нейросетевого алгоритма и оценки генетических рисков»
- Проведение комплексной МРТ позволит получить информацию о локализации и объеме структурных (традиционная МРТ, диффузионная МРТ) и функциональных (фМРТ в покое), а позитронно-эмиссионная томография с 18 ФДГ- метаболических изменениях головного мозга у пациенток с постмастэктомическим синдромом в сравнении со здоровыми женщинами - добровольцами.
- Сопоставление результатов эффективности проводимого данной категории пациенток комплекса лечебно-реабилитационных мероприятий на основании различий в функциональной активности рабочих сетей, состоянии белого вещества и метаболизма головного мозга позволит разработать универсальный нейросетевой алгоритм для превентивных и лечебных стратегий.
- Будут получены новые данные о наличии генетических маркеров развития патологии как проявлений врожденных ошибок иммунитета, что позволит применить персонифицированный подход для снижения числа осложнений медицинских манипуляций при наличии генетических рисков их развития.
- Предполагается, что полученные результаты позволят повысить эффективность проводимых лечебно-реабилитационных мероприятий и могут способствовать созданию новых схем реабилитации пациенток с постмастэктомическим синдромом на основании их эффективности в восстановлении нормальной функциональной активности рабочих сетей головного мозга, что имеет большую социально-экономическую значимость.
- Результаты проводимых исследований будут реализованы в виде востребованных в практическом здравоохранении диагностических платформ (нейросетевой-генетический алгоритм) для подходов в предикции и лечении пациенток с постмастэктомическим синдромом.
Научная новизна
- Впервые будут выявлены структурно-функциональные и метаболические нарушения головного мозга (изменение активности рабочих сетей и/или поражения проводящих путей белого вещества головного мозга, нарушения метаболизма 18 ФДГ) и проведено их сопоставление у пациенток с диагностированным постмастэктомическим синдромом.
- Впервые будут выявлены генетически детерминированные нарушения лимфатического русла у пациенток с диагностированным постмастэктомическим синдромом.
- Впервые будет дана характеристика состояния генетического профиля пациентов с нарушениями лимфатического русла, врожденными лимфовенозными мальформациями: лимфедемой и лимфангиомами.
- Будет разработана стратегия превенции и новых лечебно-реабилитационных мероприятий у пациенток с постмастэктомическим синдромом на основании созданного нейросетевого-генетического алгоритма и его корреляции с данными клинической картины, результатами нейропсихологического исследования, метаболизма головного мозга, лимфосцинтиграфии и электронейромиографии верхних конечностей.
Практическая значимость
Полученные результаты исследования позволят разработать нейросетевой-генетический диагностический алгоритм по выявлению структурных, функциональных и метаболических изменений головного мозга и генетических рисков у пациенток после радикального лечения рака молочной железы. Созданные на основании нейросетевого-генетического алгоритма и его корреляций с клиническими, нейропсихологическими, метаболизма головного мозга и данными электронейромиографии, лимфосцинтиграфии, новые персонифицированные лечебно-реабилитационные стратегии и превентивные подходы приведут к снижению потерь женщин трудоспособного возраста и затрат на их лечение.
Значимость для здравоохранения, ближайшие и отдалённые перспективы внедрения
Комплексный подход к использованию комбинированных методов реабилитации пациенток с постмастэктомическим синдромом и его превенции, на основании исследования белого вещества, метаболизма головного мозга и нейросетей, а также выявления генетических рисков развития постмастэктомического отека, позволит персонифицировать тактику и поможет вернуть к активной жизни более миллиона женщин трудоспособного возраста.
Список сотрудников
- главный научный сотрудник Фионик Ольга Владимировна
- ведущий научный сотрудник Алексеева Татьяна Михайловна
- ведущий научный сотрудник Ефимцев Александр Юрьевич
- ведущий научный сотрудник Труфанов Геннадий Евгеньевич
- лаборант-исследователь Горбунова Елена Алексеевна
- лаборант-исследователь Абросимова Елена Николаевна
- лаборант-исследователь Засыпкина Татьяна Леонидовна
- младший научный сотрудник Красникова Варвара Валерьевна
- младший научный сотрудник Левчук Анатолий Геннадьевич
Описание проекта
Рак молочной железы выходит на первое место среди онкологических заболеваний у женщин (около 20,9% от общей онкологической заболеваемости женщин) и составляет 65,5 на 100 тыс. женского населения. Основным методом лечения больных раком молочной железы является радикальная операция по удалению молочной железы (мастэктомия), в процессе выполнения которой соблюдается принцип хирургического радикализма. Оперативное лечение рака молочной железы проводится в России у 95,9% пациенток. Из них в 71% случаев операция сочетается с различными вариантами лучевой и химиотерапии. Сейчас в России живет более 2 миллионов людей, перенесших радикальное лечение по поводу рака молочной железы, и считающихся, с точки зрения онкологов практически здоровыми, но прогрессивное развитие целого ряда органических и функциональных осложнений, а также их различных комбинаций приводит к инвалидизации более 80% оперированных. Наиболее частыми осложнениями являются лимфатический отёк верхней конечности, тугоподвижность плечевого и локтевого суставов, боль, гипостезия, парезы, гипотрофии, сосудистые и вегетативные расстройства (рис 1-3). В 90% случаев отмечаются тревога и депрессия, снижение качества жизни. В более поздние сроки после операции развиваются острые и хронические нарушения кровообращения головного мозга; грубые нарушения статики и динамики позвоночника. Одним из наиболее существенных проявлений ПМЭС, приводящих к дезадаптации и снижению качества жизни пациенток, является отек верхней конечности (встречается с частотой до 90%) на стороне операции и стойкий персистирующий болевой синдром (встречается с частотой 20-50%), который приводит к увеличению частоты и уровня тревожно-депрессивных расстройств, нарушений сна, а также к снижению качества жизни пациенток.
Проблема психоневрологических нарушений при постмастэктомическом синдроме и роли современных методов нейровизуализации в оценке и прогнозе этих изменений остается мало изученной. В настоящее время практически нет работ, посвященных изучению структурно-функциональных изменений проводящих путей головного мозга, коннективности белого вещества и метаболизма головного мозга у пациенток с ПМЭС. Не изучен нейропластический потенциал данной группы больных на фоне различных лечебно-реабилитационных стратегий. Нет исследований в отработке персонифицированного подхода в предикции и реабилитации на фоне исследований белого вещества, метаболизма головного мозга и нейросетей.
Кроме того, онкологические заболевания и рак молочной железы, в частности, являются иммунозависимой патологией, имеющей генетическую детерминированность развития болезни, то есть являются следствием врожденных ошибок иммунитета, а появление осложнений медицинских манипуляций – прямое указание на наличие такой патологии. Развитие лимфатического отёка верхней конечности как проявление постмастэктомического синдрома у отдельной категории пациенток может обуславливаться наличием врожденных аномалий лимфатического русла, которые, в свою очередь, являются составляющей частью синдромов, обусловленных наличием врожденных ошибок иммунитета, что отражено в международной классификации этих болезней. Однако вопрос о роли генетических нарушений в развитии лимфатического отека, выживаемости пациентов при указанной патологии остается нерешенным до настоящего времени.
Нет исследований, результаты которых помогли бы выработать персонифицированный подход к предикции и реабилитации пациенток на основе исследований белого вещества и метаболизма головного мозга и нейросетей и выявления генетических маркеров развития лимфедемы конечностей.
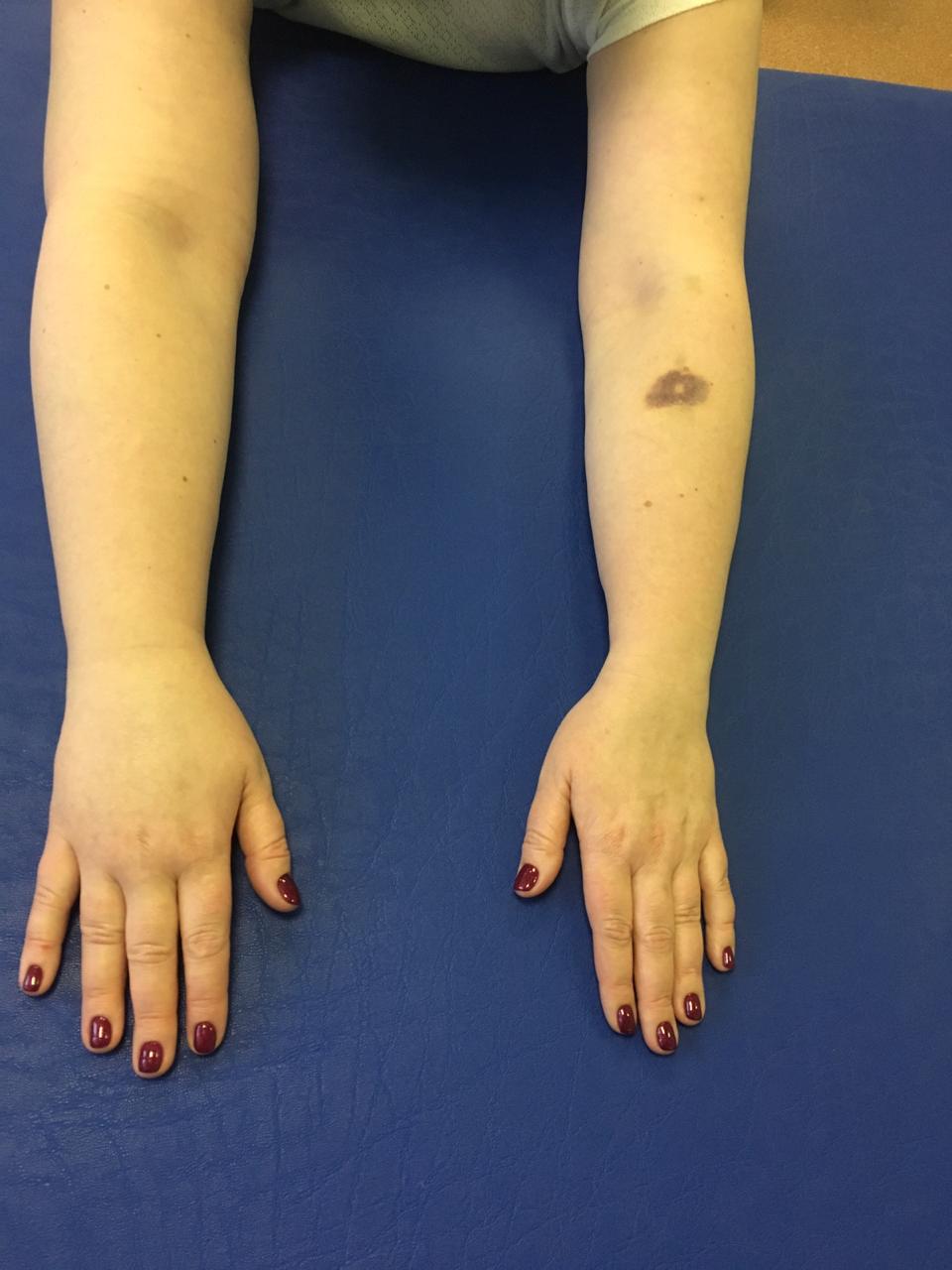
Рис.1. Постмастэктомический отек правой верхней конечности
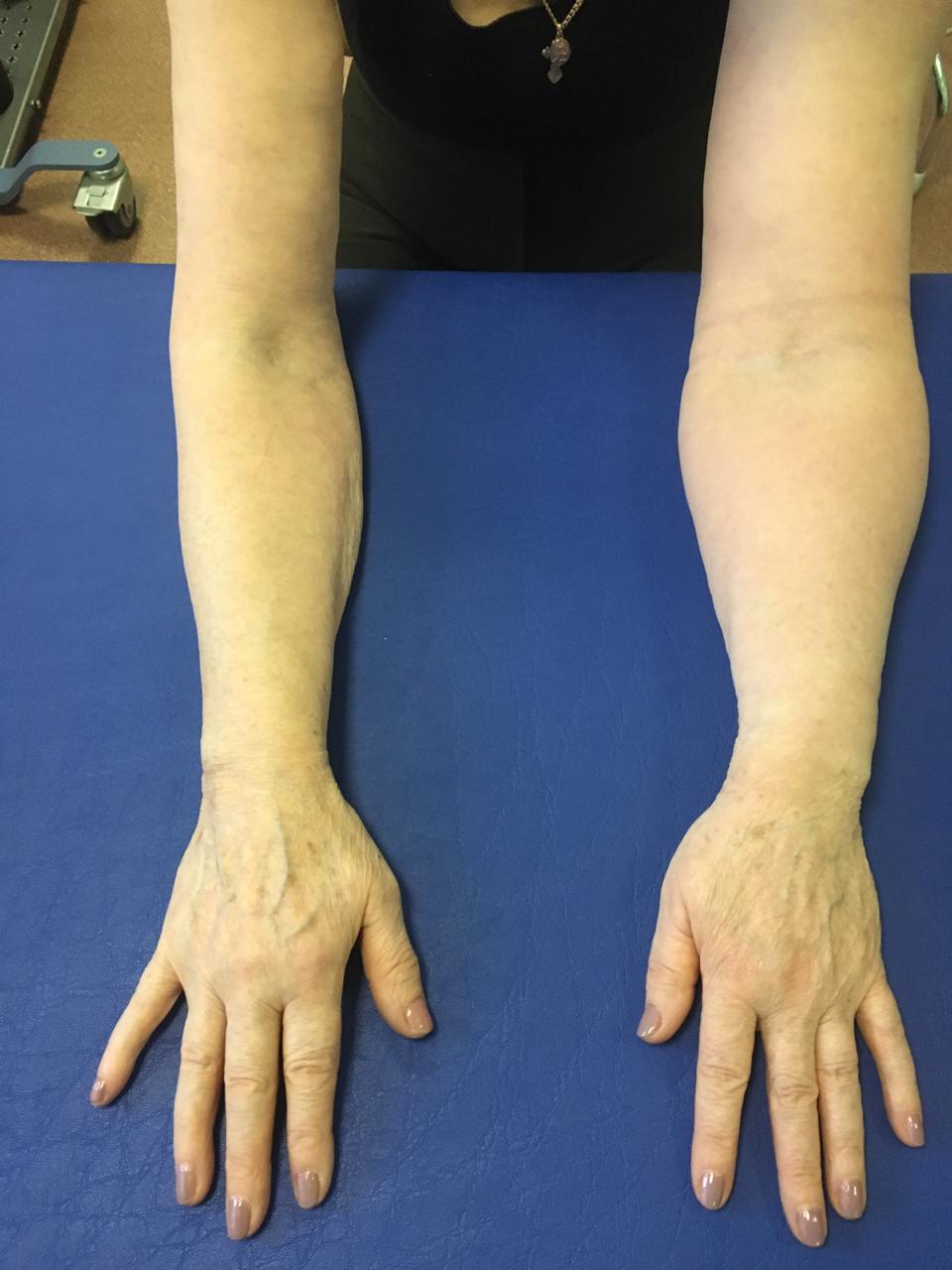
Рис.2. Постмастэктомический отек левой верхней конечности
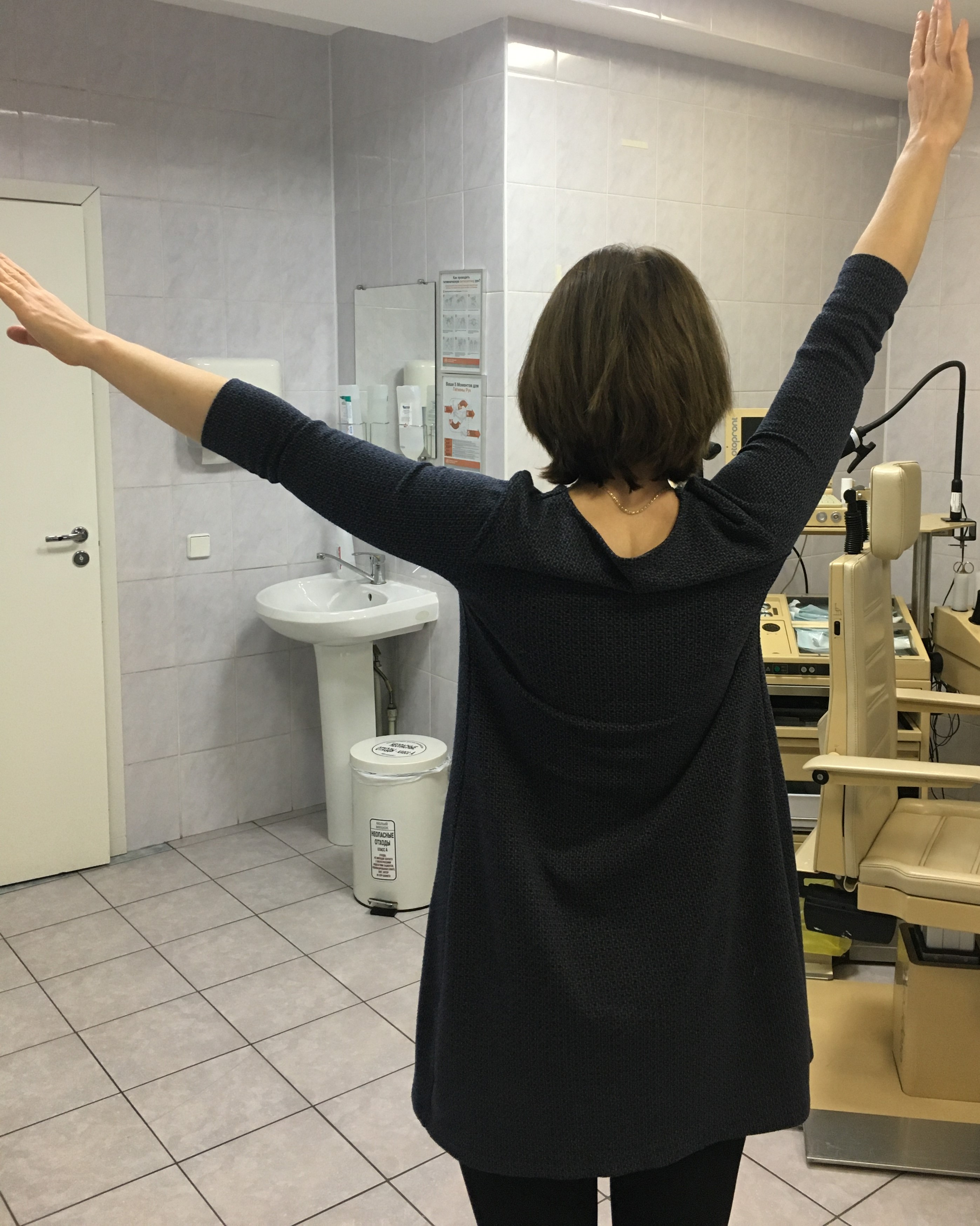
Рис.3. Ограничение амплитуды отведения в плечевом суставе через 2 года после левосторонней мастэктомии
Связь с приоритетом Персонализированная медицина
В настоящее время отсутствует полноценный алгоритм диагностики и лечения пациенток с осложнениями после перенесенного радикального лечения рака молочной железы. Результаты реабилитационных мероприятий не удовлетворяют пациента и врача, так как, в основном, направлены на коррекцию постмастэктомического отека конечности. Не отработан мультидисциплинарный подход к лечению бригадой врачей, включающей невролога (психиатра). Отсутствует в системе ОМС психологическая и психотерапевтическая помощь.
Использование функциональной, диффузионно-тензорной магнитно-резонансной томографии, позитронно-эмиссионной томографии позволит выявить структурные, функциональные и метаболические нарушения центральной нервной системы у пациенток с ПМЭС. Выявление генетических маркеров развития осложнений, включая лимфотический отек, позволит оценить риск их развития и направить медицинскую помощь в рамки персонификации, предупреждая развитие осложнений.
Предлагаемый̆ проект полностью соответствует направлению стратегии НТР РФ и направлен на решение проблемы профилактики осложнений мастэктомии и персонифицированной реабилитации женщин, перенесших радикальное лечение по поводу рака молочной железы; оценку эффективности лечебно-реабилитационных мероприятий на основе изменений функциональной активности рабочих сетей и метаболизма головного мозга, выявления генетических маркеров развития постмастэктомического отека.
Описание соответствия уровня исследований мировому и планируемых конкретных результатов проекта
В зарубежной литературе встречается ряд работ, посвященных изучению изменений функциональной активности рабочих сетей головного мозга у пациенток на фоне различных вариантов лечения рака молочной железы. Показаны эффекты химиотерапевтического и лучевого лечения на структуру и функционирование головного мозга в виде микроструктурных изменений, нарушений анатомии проводящих путей белого вещества и функциональной коннективности рабочих сетей покоя, показана повышенная уязвимость нейросетей пациенток с раком молочной железы в отношении развития нейродегенеративных процессов в будущем. Недостатком этих исследований является отсутствие внимания на наличия изначальных изменений в активности рабочих сетей и белого вещества головного мозга у пациенток до адъювантной терапии. В единичных исследованиях, посвященных изучению рабочих сетей головного мозга, показаны изменения функциональной активности в префронтальной и поясной коре по данным функциональной МРТ у пациенток с диагностированной депрессией в позднем послеоперационном периоде после тотальной мастэктомии.
Есть упоминания об использовании зарубежными коллегами функциональных исследований головного мозга для определения эффективности проводимых лечебно-реабилитационных мероприятий после оперативного лечения рака молочной железы. Например, в группах пациенток после отсроченной и немедленной реконструктивной операции на молочной железе по поводу проведенной тотальной мастэкомии, в результате анализа результатов исследования нейросетей, было показано, что одновременная с радикальной операцией реконструкция молочной железы улучшает самовосприятие и повышает качество жизни пациенток.
Применение алгоритма на основе нейросетей (по данным функциональной и диффузионно-тензорной МРТ) у пациенток с раком молочной железы в целом, и с постмастэктомическим синдромом в частности, имеет большие перспективы в качестве современного инструмента, позволяющего прогнозировать и выявлять изменения рабочих сетей головного мозга у данной категории больных, для возможности предикции развития постмастэктомического синдрома, а также осуществлять индивидуальный подход в проводимых лечебно-реабилитационных мероприятий и оценивать их эффективность в послеоперационном периоде после тотальной мастэктомии.
Известные факторы риска вторичной лимфедемы лишь частично объясняют, почему развивается лимфедема после лечения рака молочной железы, предполагая, что наследственная генетическая предрасположенность может влиять на риск. Потенциальный вклад генетической предрасположенности в риск развития вторичной лимфедемы после хирургической травмы, облучения и других повреждений тканей не изучался. Идентификация молекулярных сигнатур может облегчить прогнозирование риска лимфедемы до операции или привести к эффективной лекарственной терапии для профилактики или лечения. Последние достижения в молекулярной биологии, лежащие в основе развития лимфатической системы и связанных с ней врожденных нарушений, предполагают ряд потенциальных генов-кандидатов для изучения в связи с вторичной лимфедемой. Одной из вероятных причин клинической манифестации развития вторичной лимфедемы после лечения рака молочной железы может являться апоптоз эндотелия. Однако, анализ связи между генами, вовлеченными в эндотелиальный апоптоз, и генами, ассоциированными с лимфедемой, ранее не проводился.
Недавние исследования молекулярно-генетических основ показали обновленную генотип-фенотипическую корреляцию между лимфангиогенезом, лимфатической функцией и лимфедемой. FOXC2, EphrinB2, VEGFR-3, VEGF-C, ангиопоэтин-2, Prox-1 и подопланин оказались важными факторами генетического каскада, связывающего наследственную лимфедему, эмбриональное и постнатальное лимфатическое развитие. FOXC2 может играть ключевую роль в регуляции взаимодействия между LECs и гладкомышечными клетками, а также в морфогенезе лимфатических клапанов. Снижение активности VEGFR-3 тирозинкиназы и последующая неспособность трансдуцировать достаточные физиологические сигналы VEGF-C/ - D могут влиять на функцию и структуру ЛЭК в межклеточных соединениях и периимфатических компонентах. Идентификация генетических маркеров в моделях человека и животных облегчила бы управление факторами окружающей среды, влияющими на экспрессию и тяжесть лимфедемы, и обеспечила бы основу для разработки новых целевых методов лечения этого заболевания.
Мутации коннексина 47 (Сх47) повышают риск развития вторичной лимфедемы после лечения рака молочной железы. С клинической точки зрения интересно отметить, что у мышей с дефицитом Cx37 и Cx43 развивается порок развития лимфатических сосудов, что позволяет предположить, что они также могут быть вовлечены в заболевания лимфатических сосудов человека, такие как лимфедема. Эти провокационные, хотя и предварительные, выводы относительно возможной генетической предрасположенности к вторичной лимфедеме после лечения рака молочной железы требуют дальнейшего внимания к потенциальной репликации с использованием более крупных наборов данных.
Априорное признание генетического риска повышает потенциал раннего выявления и вмешательства для группы высокого риска и допускает возможность изменения хирургического подхода и/или химио-и лучевой терапии, или прямого медикаментозного лечения вторичной лимфедемы новыми препаратами, модифицирующими коннексин.
Таким образом, в настоящее время в литературных данных имеются лишь единичные сообщения о выявлении отдельных мутаций некоторых генов, которые могут являться патогенетически значимыми в развитии нарушений лимфатического русла. Описанные случаи касаются тех генов, мутации которых определены как значимые в развитии врожденных ошибок иммунитета, что отражено в соответствующих международных классификациях. Такие исследования носят обрывочный характер в силу разобщенности специалистов разного профиля, занимающихся только частью общей патологии. Объединение совместных усилий позволит повысить выявляемость таких случаев, предупредит развитие осложнений, учитывая генетические риски, повысит эффективность реабилитационных программ, имеющих персонифицированную направленность в лечении лимфедемы.
Основные публикации сотрудников
- Analysis of functional connectivity when using complementary methods of treatment in patients with asymptomatic carotid stenosis. Lepekhina A. S., Pospelova M.L., Trufanov G.E. et al. International Joint Conference on Biomedical Engineering Systems and Technologies. – 2020. Р. 373-378.
- NR2-антитела как диагностический и прогностический биомаркер при инсульте (обзор литературы) Топузова М.П., Алексеева Т.М., Панина Е.Б., Вавилова Т.В., Поспелова М.Л. и др. Артериальная гипертензия – 2020 – Т.26, №1.
- Головная боль напряжения. Состояние проблемы, новые аспекты этиопатогенеза, возможности нейровизуализации, немедикаментозные методы лечения (обзор литературы). Лепёхина А.С., Поспелова М.Л., Левчук А.Г., Ефимцев А.Ю., Труфанов Г.Е., Алексеева Т.М., Писковацков Д.В. Трансляционная медицина
- Том 7, № 2 (2020) – С.6-11. https://doi.org/10.18705/2311-4495-2020-7-2-6-11
- Новые диагностические и прогностические биомаркеры ишемических поражений мозга. Алексеева Т.М., Топузова М.П., Чайковская А.Д. и др. // Трансляционная медицина. – 2020. – 7 (5). – С. 29-42.
- Особенности ведения пациентов с неврологическими заболеваниями в период пандемии COVID‑19. Топузова М.П., Алексеева Т.М., Чайковская А.Д. и др. // Артериальная гипертензия. – 2020. – № 26(4). – С. 446-459.
- Постгипоксическая энцефалопатия у пациентов, перенесших аортокоронарное шунтирование: клинико-нейропсихологическое обследование, коннектом и возможности нейропротекции. Портик О.А., Царевская Ю.Н., Ефимцев А.Ю. и др. // Современные проблемы науки и образования. – 2020. – № 2. – С. 118-125. URL: http://www.science-education.ru/article/view?id=29744 (дата обращения: 08.05.2020).
- Особенности реабилитации пациентов пожилого возраста с повторными инсультами. Иванова Н.Е., Ефимова М.Ю., Алексеева Т.М. и др. // Современные проблемы науки и образования. – 2019. – № 6. URL: http://www.science-education.ru/article/view?id=29495 (дата обращения: 23.01.2020)
- Возможности гипно- и ароматерапии в лечении панических расстройств. Поспелова М.Л., Ефимцев А.Ю., Алексеева Т.М., Иванова Н.Е., Труфанов Г.Е. Современные проблемы науки и образования – 2019 - №2 URL: http://www.science-education.ru/article/view?id=28727 (дата обращения 16.04.2019)
- Возможности гипносуггестивной терапии психосоматических заболеваний. Ефимцев А.Ю., Алексеева Т.М., Иванова Н.Е., Труфанов Г.Е. Биомедицина и социология – 2019 – Т.4 (1). – С.45-49.
- Опыт сочетания медикаментозных и немедикаментозных методов коррекции гемореологических нарушений у пациентов с гипертонической энцефалопатией. Поспелова М.Л., Сорокоумов В.А., Алексеева Т.М., Иванова Н.Е. Артериальная гипертензия. – 2018. - № 24(5). – С.531-537.
Патенты
- Патент РФ 2716453 от 11.03.2020. «Способ гибридного лечения аневризмы аорты без искусственного кровообращения с поддержанием перфузии головного мозга во время транспозиции ветвей дуги аорты». Шломин В.В., Бондаренко П.Б., Пуздряк П.Д., Гусинский А.В., Фионик О.В., Гордеев М.Л.
- Патент № №2716750 от 16.03.2020 «Способ лечения больных с паническими расстройствами». Поспелова М.Л., Алексеева Т.М., Иванова Н.Е. Труфанов Г.Е., Фокин В.А., Ефимцев А.Ю., Чернышова О.А, Левчук А.Г., Исхаков Д.Н., Семибратов Н.Н.
- Патент № № 2 723 607. от 16.06.2020 «Способ оценки эффективности воздействия, относящегося к комплементарной медицине, путем функциональной магнитно-резонансной томографии при лечении больных с атеросклеротическими стенозами сонных артерий, паническими расстройствами». Поспелова М.Л., Алексеева Т.М., Иванова Н.Е., Труфанов Г.Е., Фокин В,А., Ефимцев А.Ю., Исхаков Д.Н., Зайцев Д.Е., Лепехина А.С., Топузова М.П.
- Заявка на патент РФ №037839 от 29.06.2020. Рег. № 2020122029. «Способ оценки эффективности остеопатической манипуляции, путем функциональной магнитно-резонансной томографии при лечении больных с хронической головной болью напряжения». Положительное решение о выдаче патента от 25.11.2020. Поспелова М.Л., Писковацков Д.В., Алексеева Т.М., Иванова Н.Е., Труфанов Г.Е., Ефимова М.Ю., Ефимцев А.Ю., Лепехина А.С., Буккиева Т.А., Левчук А.Г., Топузова М.П.
- Патент № 2682867 от 21.03.2019. «Способ лечения больных с хроническими ишемическими цереброваскулярными заболеваниями». Поспелова М.Л., Алексеева Т.М., Сорокоумов В.А.. Иванова Н.Е
Контакты
Поспелова Мария Львовна, руководитель группы персонифицированного лечения постмастэктомического синдрома, +7-911-176-90-84, pospelovaml@mail.ru
